Alpha-1-Antitrypsin-Mangel: Seltene Mutationen
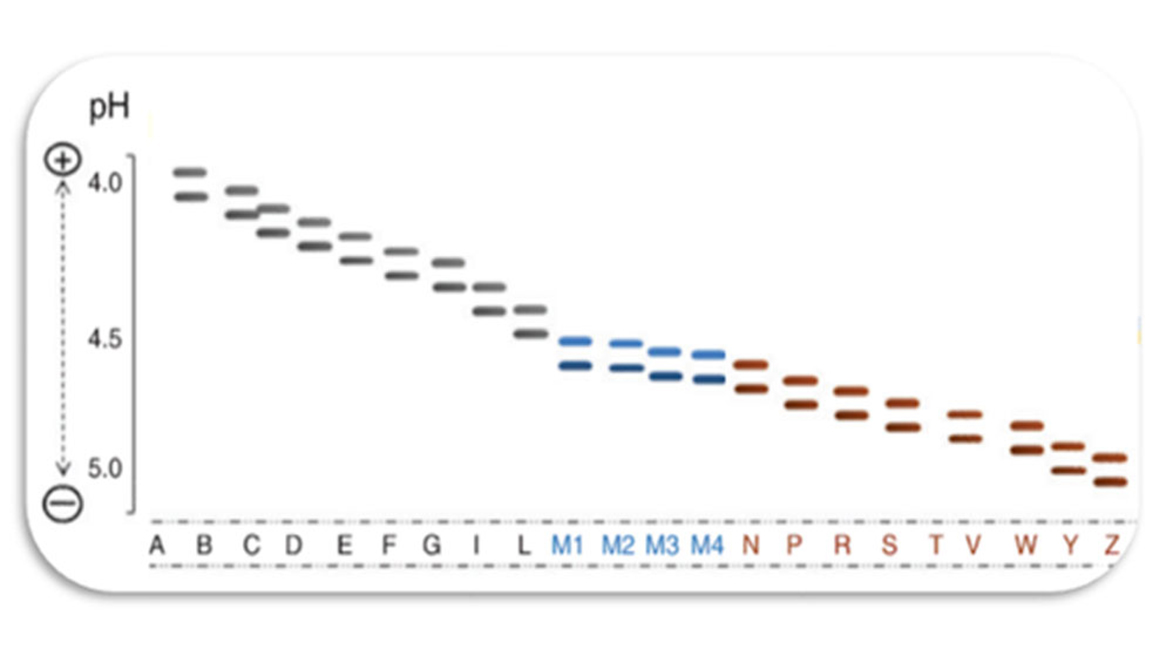
Die Ursache für den Alpha-1-Antitrypsin-Mangel (AAT-Mangel) sind Mutationen (Veränderungen) im SERPINA1-Gen (Serin-Protease-Inhibitor A1-Gen), welches sich auf dem Chromosom 14 befindet. Das AAT-Gen weist eine beträchtliche genetische Variabilität auf. Mittlerweile sind über 100 verschiedene Mutationen des SERPINA1-Gens bekannt, darunter auch viele seltene Mutationen, die zu Strukturveränderungen von AAT führen können und somit Krankheitsbilder unterschiedlichen Schweregrades haben können. Mutationen dieses Gens können, müssen aber nicht zum Mangel an AAT führen. Je nach Art und Stelle der Mutation auf dem SERPINA1-Gen ist das AAT-Protein in der Funktion mehr oder weniger eingeschränkt bis hin zum kompletten Fehlen des AAT-Proteins. Bei manchen Mutationen, z. B der häufig auftretenden Z-Mutation, kommt es zu einer Anhäufung des Moleküls in der Leber und dadurch zu einem Mangel von AAT im gesamten Organismus, wodurch die Schutzfunktion (enzymatischer Abbau von Lungengewebe) nicht mehr oder nur noch teilweise erfüllt wird. Dies kann zu einer Funktionsstörung verschiedener Organe, insbesondere der Leber und Lunge führen. Die AAT-Allel-Varianten werden in Gruppen eingeteilt: Normal (Pi*M-Allel) = normaler AAT-Serumspiegel, Defizienz = signifikante Reduktion des AAT-Serumspiegels, Null (Q0) = kein AAT nachweisbar. Die unterschiedlichen Mutationen werden mit Buchstaben von A-Z und Null (Q0) bezeichnet und richten sich nach der Wanderungsgeschwindigkeit bei der pH-Wert-abhängigen elektrophoretischen Auftrennung des Alpha-1-Proteins. Das normale (gesunde) Allel wird als M bezeichnet (Abb.1).
Homozygote, heterozygote und compound heterozygote Formen
Da das Genom des Menschen aus einem doppelten Chromosomensatz besteht, bezeichnet die Formel Pi*MM einen gesunden Menschen ohne Mutation (Pi steht dabei für Protease-Inhibitor, die beiden folgenden Großbuchstaben geben den Zustand der beiden Allele an). Es wird zwischen homozygoten, heterozygoten und compound heterozygoten Formen unterschieden. Homozygot meint, dass beide Allele identisch sind, im Falle einer Krankheit also beide Allele dieselbe krankmachende Mutation aufweisen (z.B. Pi*ZZ). Bei der heterozygoten Form ist hingegen nur eine Genkopie (Allel) von der Mutation betroffen, die andere liegt unverändert vor (z.B. Pi*MZ). Bei der compound heterozygoten Mutation befinden sich zwei unterschiedliche Mutationen auf beiden Allelen (z.B. Pi*SZ). Die meisten seltenen Mutationen haben zusätzlich zu dem Buchstaben noch einen Namen, der sich nach dem Geburtsort des Patienten oder nach dem Ort bzw. dem Institut richtet, wo die Mutation als erstes entdeckt wurde, z.B. Pi*MWürzburg, Pi*LOffenbach, Pi*YBarcelona, Pi*Q0Mattawa. Es gibt einige sehr seltene Mutationen, die bis jetzt nur einmal detektiert wurden. Bei manchen dieser Mutationen wurde kein Name vergeben, hier wird nur die genaue Stelle der Mutation auf dem Gen angegeben, z.B. c.221T > A.